各有關(guān)單位:
鑒于現(xiàn)正執(zhí)行的新型冠狀病毒(2019-nCoV)檢測試劑和相關(guān)醫(yī)用耗材采購周期將于2022年5月25日屆滿�。根據(jù)《國家醫(yī)療保障局辦公室 國務院應對新型冠狀病毒肺炎疫情聯(lián)防聯(lián)控機制醫(yī)療救治組關(guān)于降低新冠病毒核酸檢測價格和費用的通知》(醫(yī)保辦發(fā)〔2022〕5號)精神以及工作安排,廣東省藥品交易中心現(xiàn)組織開展廣東聯(lián)盟新型冠狀病毒(2019-nCoV)檢測試劑和相關(guān)耗材帶量采購接續(xù)(以下簡稱廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購)工作�,有關(guān)事項通告如下:
一、采購主體
本次參與的采購主體為聯(lián)盟地區(qū)具有采購相關(guān)品種資質(zhì)的公立醫(yī)療機構(gòu)(含軍隊醫(yī)療機構(gòu)��,下同)和疾控機構(gòu)���,聯(lián)盟地區(qū)內(nèi)醫(yī)保定點社會辦醫(yī)療機構(gòu)����、第三方檢驗機構(gòu)���、零售藥店可自愿參加�����。
二、采購范圍�、分類與報量
(一)品種范圍
本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購品種為新型冠狀病毒(2019-nCoV)核酸檢測試劑、IgM抗體檢測試劑��、IgG抗體檢測試劑、IgM/IgG抗體檢測試劑�����、總抗體檢測試劑�����、抗原檢測(含自測)試劑�����、核酸提?。兓┰噭约靶滦凸跔畈《緳z測配套的樣本采集器具類�、一次性使用無菌注射器(新冠疫苗接種用,以下簡稱新冠疫苗注射器)類醫(yī)用耗材���。
(二)產(chǎn)品分類
本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購符合申報資格的產(chǎn)品分為以下8個類別:
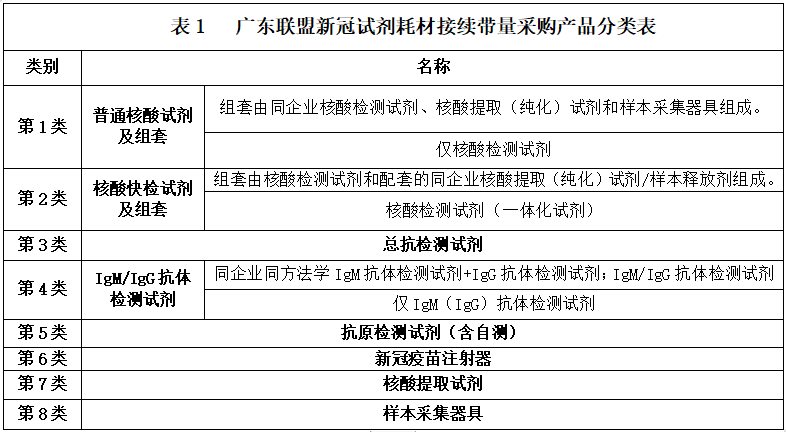
第2類“核酸快速檢測”是指由國家衛(wèi)生健康委臨床檢驗中心界定的屬于新型冠狀病毒核酸快速檢測的產(chǎn)品��?�!昂怂崽崛?���、擴增檢測均在同一封閉、便攜式儀器上完成���;樣本上機后至結(jié)果報告過程�,無需任何手工操作�����,且全流程時間不超過90分鐘�����?�!保▏倚l(wèi)生健康委臨床檢驗中心【衛(wèi)檢中字〔2020〕第15號】)
(三)報量
本次聯(lián)盟地區(qū)包括廣東�、陜西、山西���、遼寧��、黑龍江���、江西��、湖南、廣西���、海南�����、重慶�����、貴州��、云南��、甘肅��、青海���、寧夏、內(nèi)蒙古���、新疆���、新疆建設兵團等(具體參與省份以報價通知為準),公布中選價格后����,聯(lián)盟?����。ㄊ?、區(qū))自行組織開展報量工作。
三�����、采購周期和采購協(xié)議
(一)本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購周期原則上自中選結(jié)果實際執(zhí)行日起至2023年5月25日�。對企業(yè)的中選價格聯(lián)盟地區(qū)內(nèi)的醫(yī)療機構(gòu)不得二次議價。中選結(jié)果的實施時間�、預采購量以及采購方式等事宜,以聯(lián)盟地區(qū)各?���。ㄊ小^(qū))公布的為準���。
(二)在本次采購周期執(zhí)行前�����,簽訂采購協(xié)議��,中選產(chǎn)品一律按新的中選價格執(zhí)行�。中選企業(yè)無法供應致使協(xié)議無法繼續(xù)履行���,由采購主體在中選產(chǎn)品中自主選擇替補供應企業(yè)�����。
(三)采購周期內(nèi)采購主體完成當年協(xié)議采購量�����,繼續(xù)采購中選產(chǎn)品����,中選企業(yè)按中選價格進行供應�����,直至采購周期屆滿�。
四、申報企業(yè)須知
(一)申報企業(yè)須在規(guī)定時間內(nèi)提交符合要求的申報材料,未提交的或截止日前仍未提交符合要求申報材料的����,將影響該企業(yè)所涉及產(chǎn)品在聯(lián)盟地區(qū)范圍內(nèi)的新冠試劑耗材接續(xù)帶量采購活動,其后果自負����。
(二)申報企業(yè)的產(chǎn)品應當符合國家有關(guān)部門的質(zhì)量標準要求,并按國家有關(guān)部門要求組織生產(chǎn)�����,在本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購申報截止日前兩年內(nèi)��,無省級及以上藥品監(jiān)督管理部門的質(zhì)量檢驗不合格記錄��。
(三)申報企業(yè)應遵守專利法�、反不正當競爭法等相關(guān)法律法規(guī),并承擔相關(guān)法律責任�����。如在申報及采購周期內(nèi)���,本中心收到相關(guān)有權(quán)司法機關(guān)對申報企業(yè)/中選企業(yè)/中選產(chǎn)品侵犯他人權(quán)利的判決�����、裁決�����、決定����、裁定等司法文書��,或司法機關(guān)關(guān)于申報產(chǎn)品/中選產(chǎn)品采取包括不限于禁止銷售等保全措施的����,對于正在申報的企業(yè)本中心將取消其申報和比選資格;對于已中選的產(chǎn)品����,如中選企業(yè)在獲悉上述情況后1日內(nèi)未主動暫停掛網(wǎng)交易,本中心將主動暫停所涉產(chǎn)品掛網(wǎng)交易�,由此產(chǎn)生的一切經(jīng)濟和法律責任均由該企業(yè)自行承擔。
(四)對于代理商而言�,申報企業(yè)或中選企業(yè)須持續(xù)持有產(chǎn)品的完整代理資格,如在申報��、采購周期內(nèi)代理資格終止的,本中心將取消其申報和競價比選資格�,或取消以其名義在平臺掛網(wǎng)交易中選產(chǎn)品之資格,由此產(chǎn)生的一切經(jīng)濟和法律責任均由該企業(yè)自行承擔�����。
(五)申報企業(yè)對產(chǎn)品的質(zhì)量負責��,一旦中選��,作為供應保障的第一責任人����,及時、足量按要求組織生產(chǎn)�,并向配送企業(yè)發(fā)送產(chǎn)品,滿足醫(yī)療機構(gòu)臨床使用需求�����。
五�����、申報要求
(一)申報產(chǎn)品須符合采購品種范圍并取得有效中華人民共和國醫(yī)療器械注冊(備案)證(以下簡稱注冊(備案)證)�;本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購以注冊(備案)證作為申報單元��。
(二)已取得采購品種范圍內(nèi)產(chǎn)品合法資質(zhì)的醫(yī)療器械生產(chǎn)企業(yè)���、醫(yī)療器械注冊(備案)人,在質(zhì)量標準����、生產(chǎn)能力、供應穩(wěn)定性���、企業(yè)信用等方面達到本次聯(lián)盟帶量采購要求的,作為申報企業(yè)��,均可參加����。境外醫(yī)療器械注冊(備案)人應當指定我國境內(nèi)唯一企業(yè)法人協(xié)助履行相應法律義務。同一企業(yè)同一醫(yī)療器械注冊(備案)證���,不同規(guī)格型號委托不同企業(yè)進行申報的����,為無效申報����。
(三)各類申報具體要求:
1.第1類核酸普通檢測:指取得國家醫(yī)療器械注冊(備案)證的新型冠狀病毒(2019-nCoV)核酸檢測試劑�、核酸提?�。兓┰噭?�、樣本采集器具�。核酸普通檢測按組套申報時須同時申報同企業(yè)核酸檢測試劑、核酸提?�。兓┰噭┖蜆颖静杉骶?��;1個核酸檢測試劑注冊證僅可組成1套,配備同企業(yè)核酸提?��。兓┰噭?樣本采集器具各1個證。組套申報的同企業(yè)核酸提取試劑類和樣本采集器具類產(chǎn)品須符合第7�、8類申報要求,申報第1類的核酸提?���。兓┰噭┎坏猛瑫r申報第7類,申報第1類的樣本采集器具不得同時申報第8類��。
2.第2類核酸快速檢測:指取得國家醫(yī)療器械注冊證的新型冠狀病毒(2019-nCoV)核酸檢測試劑盒/核酸提?���。兓┰噭?樣本釋放劑��;且符合國家衛(wèi)生健康委臨床檢驗中心界定的核酸快速檢測產(chǎn)品����。第2類核酸快速檢測按新型冠狀病毒(2019-nCoV)核酸檢測試劑和同企業(yè)核酸提?��。兓┰噭┻M行組套申報����。若核酸快速檢測無需另外配套核酸提取試劑類�����,則僅按新型冠狀病毒(2019-nCoV)核酸檢測試劑盒進行申報����。
3.第3類總抗檢測試劑:指取得國家醫(yī)療器械注冊證的新型冠狀病毒(2019-nCoV)抗體檢測試劑盒�����。
4.第4類IgM/IgG抗體檢測試劑:指取得國家醫(yī)療器械注冊證的新型冠狀病毒(2019-nCoV)IgM/IgG 抗體檢測試劑盒���、IgM抗體檢測試劑盒�、IgG 抗體檢測試劑盒。同一企業(yè)同時具有新型冠狀病毒(2019-nCoV)IgM抗體檢測試劑盒注冊證和新型冠狀病毒(2019-nCoV)IgG抗體檢測試劑注冊證的��,按新型冠狀病毒(2019-nCoV)IgM/IgG抗體檢測試劑進行申報�����。
5.第5類抗原檢測試劑(含自測):指取得國家醫(yī)療器械注冊證的新型冠狀病毒(2019-nCoV)抗原檢測試劑盒����。其中自測指符合國務院應對新型冠狀病毒肺炎疫情聯(lián)防聯(lián)控機制綜合組《關(guān)于印發(fā)新冠病毒抗原檢測應用方案(試行)的通知》(聯(lián)防聯(lián)控機制綜發(fā)〔2022〕21號)的要求,可通過零售藥店自行購買及自測的抗原檢測類試劑���。
6.第6類新冠疫苗注射器:指取得國家醫(yī)療器械注冊證的一次性使用無菌注射器類醫(yī)用耗材�����;產(chǎn)品質(zhì)量需符合GB15810-2019�、GB15811-2016和GB∕T18457-2015�,并通過ISO13485認證或CE認證。產(chǎn)品范圍如下:容量1ml��,標識的最大刻度1ml,最小刻度0.1ml���,針頭0.5×16RW LB或0.45×16RW LB���;容量2ml,標識的最大刻度2ml���,最小刻度0.1ml�����,針頭0.5×16 RW LB�。
7.第7類核酸提取試劑:指取得國家醫(yī)療器械注冊(備案)證的核酸提?����。兓┰噭?����。適用于新型冠狀病毒(2019-nCoV)核酸配套檢測��,主要用于核酸的提取����、富集、純化等步驟�,其處理后的產(chǎn)物用于臨床體外檢測使用。本次采購的核酸提?����。兓┰噭﹥H指用于機器使用的產(chǎn)品����,包含專機專用和非專機專用產(chǎn)品。
8.第8類樣本采集器具:指取得國家醫(yī)療器械注冊(備案)證的樣本采集器具����,用于新型冠狀病毒(2019-nCoV)樣本的采樣收集與保存,主要由拭子和含保存液的杯�����、管等組成�,保存液包含滅活型和非滅活型產(chǎn)品����。樣本采集器具申報時須同時申報保存液和拭子(兩者可為不同品牌���,由保存液生產(chǎn)企業(yè)進行申報)�����,保存液的容量須包含大于或等于3ml的規(guī)格�����;若申報時僅申報保存液或拭子其中一種的品種�����,不屬于本次報名范圍����。
(四)參與本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購的報名產(chǎn)品�����,除不可抗的因素造成供應困難外����,申報企業(yè)應保證在采購周期按照中選(掛網(wǎng))價格及時足量供應滿足聯(lián)盟地區(qū)采購需求。如中選后放棄中選資格的或聯(lián)盟地區(qū)省級主管部門界定不能保障使用需求的注冊(備案)證產(chǎn)品�����,下個采購周期將不再邀請其參加該產(chǎn)品相關(guān)的集采活動��。
六����、報價要求
1.企業(yè)報價以最小使用單位(人份/套/支)為計價單位,申報價貨幣單位為人民幣(元)���,四舍五入保留小數(shù)點后2位�����。
2.申報價為申報企業(yè)的實際供應價����,應包含稅費���、配送費等在內(nèi)的所有費用�����。
3.有效申報價應不高于下表所列對應類別的價格(以下簡稱P0)�,申報價不高于對應類別的P0價格,申報價高于P0的視為無效報價�����。

4.第1類核酸普通檢測中按組套申報的�����,須同時申報核酸檢測試劑��、核酸提?�。兓┰噭?、保存液、拭子的價格���,由系統(tǒng)自動計算出對應組套總申報價�����;不按組套申報的則僅申報核酸檢測試劑的價格���。
5.第2類核酸快速檢測產(chǎn)品按新型冠狀病毒(2019-nCoV)核酸檢測試劑和核酸提取(純化)試劑/樣本釋放劑組套申報總價格��。若核酸快速檢測無需另外配套核酸提取(純化)試劑的�����,則核酸快速檢測的申報價僅按新型冠狀病毒(2019-nCoV)核酸檢測試劑申報一個價格���。
6.第4類中新型冠狀病毒(2019-nCoV)IgM/IgG抗體檢測試劑需分別填寫IgM和IgG的價格。僅有IgM(IgG)抗體檢測試劑的按新型冠狀病毒(2019-nCoV)IgM(IgG)抗體檢測試劑進行報價�。
7.第8類樣本采集類醫(yī)用耗材的申報價需按保存液和拭子的數(shù)量比例為1:1(1人份)進行組套報價,即樣本采集類產(chǎn)品1人份的總申報價為1瓶保存液的申報價+1根拭子的申報價����,若同組套內(nèi)拭子報價高于保存液報價的為無效報價。(若保存液和拭子的數(shù)量比例為1:5或1:10���,實際供應樣本采集器具(含保存液和拭子)的總價格為1瓶保存液的價格加5根或10根拭子的價格���。)
8.同競爭單元同企業(yè)同類型產(chǎn)品不同注冊(備案)證申報價格須相同;若申報價格不同�,僅最低申報價為有效報價,高于最低申報價的為無效報價�����。
9.規(guī)定時間內(nèi)未報價或報錯價的,報價結(jié)束后不得補報或修改�����,由此引起的一切后果由申報企業(yè)自行負責����。
七、A���、B采購單的形成
符合申報資格的8類產(chǎn)品按不同的競價方式形成擬中選結(jié)果��,根據(jù)不同的競價方式分為A采購單和B采購單��。在同類別A/B采購單中符合報名資格的注冊證僅參加A/B采購單的競價��。第1類按核酸檢測試劑的采購量區(qū)分A/B單��。第4類同企業(yè)同方法學IgM抗體檢測試劑與IgG抗體檢測試劑的采購量相加計算��,同注冊證IgM/IgG抗體檢測試劑的采購量按乘以2計算�����,區(qū)分A/B單�。各類別聯(lián)盟地區(qū)歷史采購量、廣東省報量和A采購單另行公布�����。
(一) A采購單
1.第1���、4、5���、6�����、7�����、8類中符合以下條件之一的納入A采購單:
①按類別匯總合計每個申報且符合采購文件要求的注冊(備案)證對應聯(lián)盟地區(qū)歷史采購量����,計算每一類別中每個注冊(備案)證上述聯(lián)盟地區(qū)歷史采購量占聯(lián)盟地區(qū)同一類別總歷史采購量的比例��,按其占比從高到低累計達80%范圍內(nèi)的注冊(備案)證列入A采購單���。
②按類別匯總合計每個申報且符合采購文件要求的注冊(備案)證廣東省公立醫(yī)療機構(gòu)和疾控機構(gòu)報量�����,計算每一類別中每個注冊(備案)證廣東省報量占同一類別總報量的比例�����,按其占比從高到低累計達80%范圍內(nèi)的注冊(備案)證列入A采購單��。其中�����,廣東省公立醫(yī)療機構(gòu)和疾控機構(gòu)報量時“抗原檢測試劑”類和“抗原檢測試劑(自測)”類對應的前80%的注冊證均列入第5類抗原檢測試劑(含自測)A采購單���。
2.第2�、3類所有申報且符合采購文件要求的注冊(備案)證全部列入A采購單�����。
(二) B采購單
第1�、4、5、6�、7、8類中列入A采購單以外的申報且符合采購文件要求的注冊(備案)證列入B采購單���。
八����、中選產(chǎn)品和價格確認
(一)申報企業(yè)按計價單位(人份/套/支)合理申報價格���;第1���、2�、8類按組套總申報價參與排序;按下述條件確認擬中選資格和擬中選價格���。
1.A采購單中符合以下條件之一的獲得擬中選資格���,并獲得對應類別聯(lián)盟地區(qū)本注冊(備案)證公立醫(yī)療機構(gòu)填報的意向采購量100%:
①同類別注冊(備案)證按有效申報價由低到高依次順位排序:有效報價注冊(備案)證數(shù)10(含本數(shù))個以下的,末位有效申報價最高的1個注冊(備案)證淘汰�����;有效報價注冊(備案)證數(shù)為11(含本數(shù))個及以上的,淘汰末位有效申報價最高的2個注冊(備案)證����;與淘汰注冊(備案)證有效申報價格相同的注冊(備案)證,均淘汰��。
第1類按組套進行排序��,僅申報核酸檢測試劑的���,其有效申報價不高于組套申報的核酸檢測試劑最高擬中選價格的��,獲得擬中選資格����。
②同類別注冊(備案)證有效申報價比對應P0的降幅≥50%的����。
2.B采購單中符合以下條件之一的獲得擬中選資格,并獲得對應類別聯(lián)盟地區(qū)本注冊(備案)證公立醫(yī)療機構(gòu)填報的意向采購量100%:
①同類別按有效申報價由低到高依次順位排序�����,每個類別參與排序的所有有效申報價中排名前50%(四舍五入取整)的注冊(備案)證獲得對應類別擬中選資格�;與淘汰注冊(備案)證有效申報價格相同的注冊(備案)證,均淘汰。
第1類按組套進行排序����,僅申報核酸檢測試劑的,其有效申報價不高于第1類A采購單中組套申報的核酸檢測試劑最高擬中選價格的��,則獲得擬中選資格���。第4類若同企業(yè)僅有 IgM 抗體檢測試劑注冊證無 IgG 抗體檢測試劑注冊證的�����,其有效申報價不高于 IgM/IgG 抗體檢測試劑 B 采購單擬中選企業(yè) IgM 抗體檢測試劑最高申報價格的���,則獲得擬中選資格;同企業(yè)僅有 IgG 抗體檢測試劑同法處理����。
②同類別注冊(備案)證有效申報價比對應P0的降幅≥50%的����。
3.獲得擬中選資格的產(chǎn)品對應的申報價格為擬中選價格。
(二)如擬中選產(chǎn)品在本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購報名截止時間前��,有全國各省集中采購最低中選價格、各省最低中選(掛網(wǎng))價格低于本次擬中選價格���,公示期內(nèi)擬中選產(chǎn)品價格將按企業(yè)申報的或公示期內(nèi)收到反饋的上述全國最低中選(掛網(wǎng))價進行調(diào)平��,不接受調(diào)平視為放棄擬中選資格��。
(三)擬中選且公示期無異議的產(chǎn)品為本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購中選產(chǎn)品���,對應的接受調(diào)平后的擬中選價格為中選價格。
九�����、其他
(一)屬于本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購范圍內(nèi)中選產(chǎn)品范圍外的產(chǎn)品可掛網(wǎng)交易���,企業(yè)自主申報全國最低價為掛網(wǎng)價格����。在采購周期內(nèi)��,若國家和省有新規(guī)定的��,從其規(guī)定�����。
(二)申報企業(yè)須對所提交材料的真實性、有效性�����、合法性負責��;對錯報���、漏報或報送虛假材料的中選企業(yè)���,一經(jīng)查實或經(jīng)舉報核實的,中選資格無效���,醫(yī)療機構(gòu)可重新采購其它中選產(chǎn)品����;并轉(zhuǎn)上級主管部門依據(jù)相關(guān)規(guī)定嚴肅處理��,相應責任由企業(yè)自行承擔��。
(三)申報企業(yè)���、醫(yī)療器械生產(chǎn)企業(yè)�、注冊(備案)人未被列入當前《全國醫(yī)藥價格和招標采購失信企業(yè)風險警示名單》�����,未被聯(lián)盟地區(qū)依據(jù)醫(yī)藥價格和招標采購信用評價制度評定為“特別嚴重”或“嚴重”失信等級�����。
(四)在采購周期內(nèi)����,在完成協(xié)議采購量后,公立醫(yī)療機構(gòu)(含未報量的公立醫(yī)療機構(gòu))原則上繼續(xù)采購使用中選產(chǎn)品���,醫(yī)保定點社會辦醫(yī)療機構(gòu)和零售藥店的采購量由供需雙方按采購協(xié)議的約定執(zhí)行���。
(五)采購周期執(zhí)行過程中,采購主體采購第1類核酸普通檢測類中選組套產(chǎn)品時���,可按組套為采購單位進行采購�,也可單獨采購組套中的核酸檢測試劑�����、核酸提取試劑、樣本采集器具���;單獨采購中選核酸提?�。兓┰噭┑膬r格不高于第7類最高中選價格(含接受按第7類最高中選價格調(diào)平的)��,單獨采購中選樣本采集器具的價格不高于第8類最高中選價格的(含接受按第8類最高中選價格調(diào)平的)���。第2類核酸快速檢測類產(chǎn)品僅可按組套進行采購。
(六)聯(lián)盟地區(qū)省級醫(yī)療保障部門根據(jù)本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購中選結(jié)果自行確定執(zhí)行時間和相關(guān)配套措施����,并組織簽訂采購協(xié)議。
(七)本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購���,申報企業(yè)按報名通知(另行發(fā)布)要求���,在規(guī)定時間內(nèi)登錄省平臺(https://www.gdmede.com.cn/)醫(yī)用耗材交易系統(tǒng)提交報名。
(八)本次廣東聯(lián)盟新冠試劑耗材接續(xù)帶量采購采取線上報價方式�����,申報企業(yè)按報價通知(另行發(fā)布)要求���,在規(guī)定時間內(nèi)登錄省平臺(https://www.gdmede.com.cn/)醫(yī)用耗材交易系統(tǒng)進行報價�。
(九)本通告內(nèi)容僅適用于廣東聯(lián)盟新型冠狀病毒(2019-nCoV)檢測試劑和相關(guān)醫(yī)用耗材帶量采購接續(xù)工作所述項目的醫(yī)用耗材及相關(guān)服務����,最終解釋權(quán)歸廣東省藥品交易中心。
十���、聯(lián)系方式
名稱:廣東省藥品交易中心
地址:廣州市越秀區(qū)環(huán)市東路華僑新村光明路28號3A樓
電話:020-38036183���、020-38036197
傳真:020-38830256
在線咨詢:廣東省藥品交易中心官網(wǎng)在線客服。
廣東省藥品交易中心
2022年4月 21日